
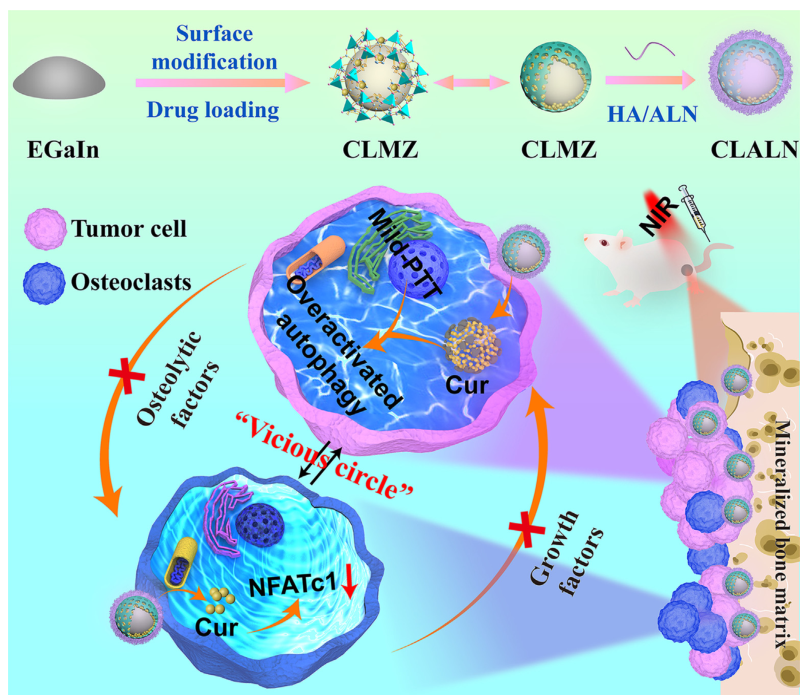
靶向原理:本文开发了一种治疗骨转移和缓解骨吸收的策略,该策略基于液体金属(LM)纳米颗粒,通过自噬激活抵抗轻度PTT引起的热阻。简言之,将LM和自噬活化剂(Curcumin,Cur)加载到沸石咪唑盐框架-8(ZIF-8)中,然后用透明质酸/阿仑膦酸盐使其功能化,得到CLALN。CLALN联合轻度PPT通过诱导受损的自噬来显著抑制肿瘤进展,并减少轻度PTT触发的程序性细胞死亡配体1(PD-L1)蛋白的表达,抵抗热阻并缓解免疫抑制。
材料合成:探针超声处理获得了包裹有薄二氧化硅壳的LM。在冰浴中超声处理下进一步添加CES(引入羧基)制备LMS。羧基与Zn2+之间存在强烈的配位效应,有利于LMS表面ZIF-8涂层的后续包裹(LMZ)。LMZ和Cur搅拌合成。然后由于ZIF-8的锌离子与HA/ALN的带负电荷的羧基之间的强烈相互作用,得到的物质被骨/肿瘤双靶向配体HA/ALN成功地功能化。
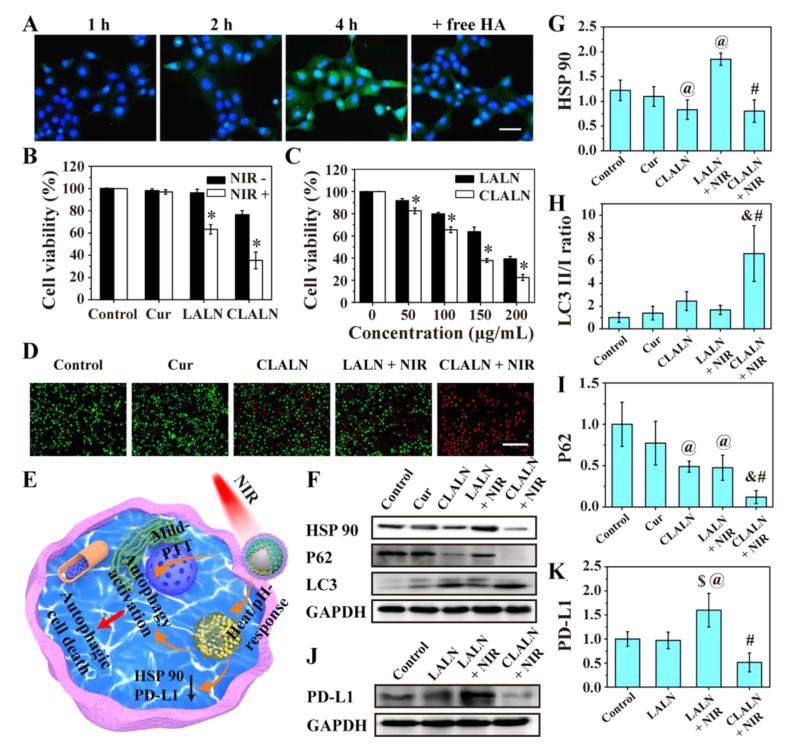
HSP 90是一种应激蛋白,其高表达诱导肿瘤细胞的热应激抗性,从而降低PTT的作用。然而,自噬诱导剂 Cur可抑制由PTT引起的 HSP 90的表达。
轻度热应激会上调肿瘤细胞中PD-L1的表达,导致免疫抑制并降低治疗效果,CLALN可以通过有效降低轻度PTT诱导的PD-L1蛋白的表达来缓解免疫抑制微环境。
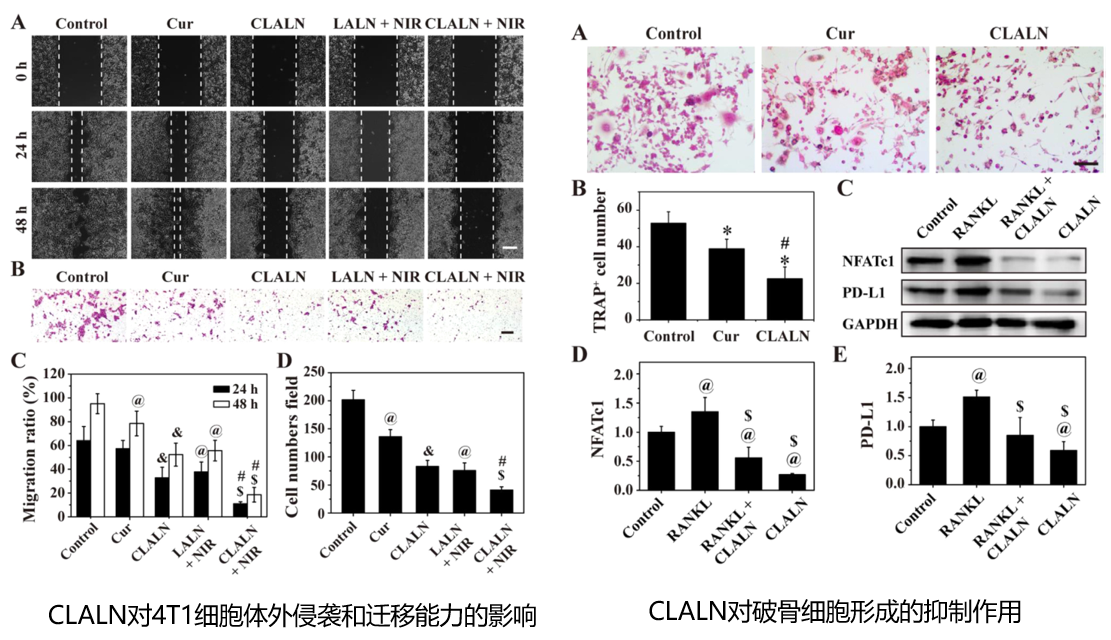
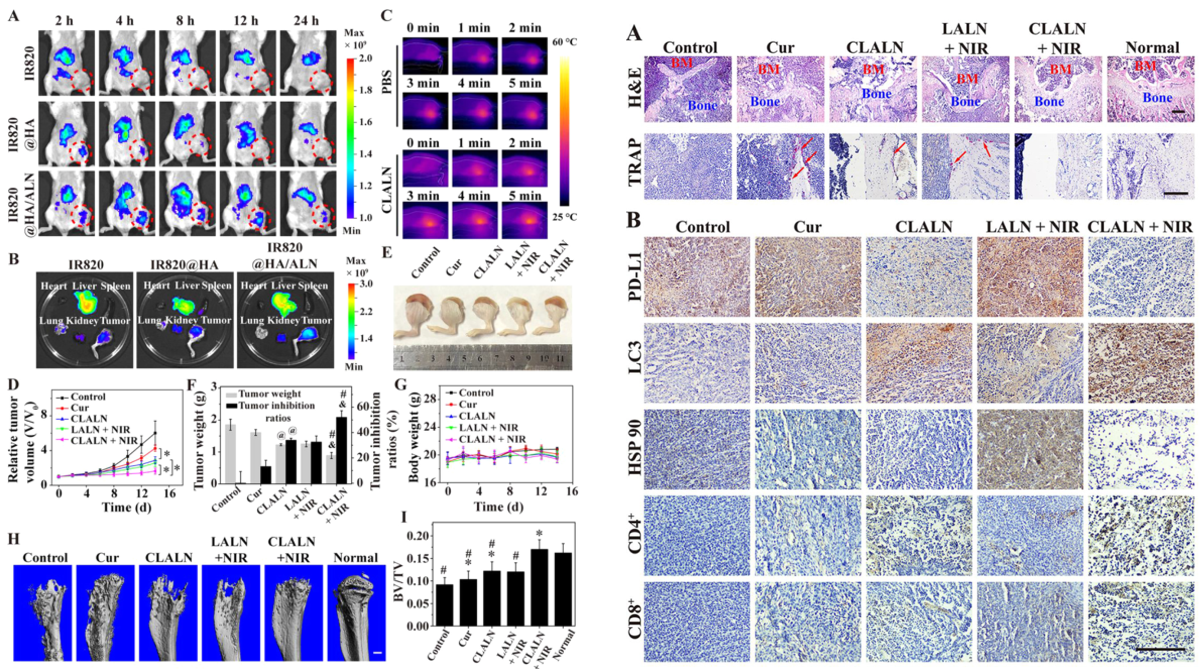
总结:CLALAN具有良好的光热性能、在酸性环境下的药物释放能力、在骨转移部位的特异性识别和聚集性。CLALAN联合轻度PTT可诱导自噬受损,降低轻度PTT触发的程序性细胞死亡配体1(PD-L1)蛋白的表达,从而显著抑制肿瘤进展,抵抗热阻,缓解免疫抑制。此外,与仅CLLN或轻度PPT相比,CLLN联合轻度PPT有效缓解骨溶解。这种基于LM的多功能纳米颗粒与自噬激活相结合,为骨转移治疗提供了一种有前景的治疗策略。
指导教师:张振